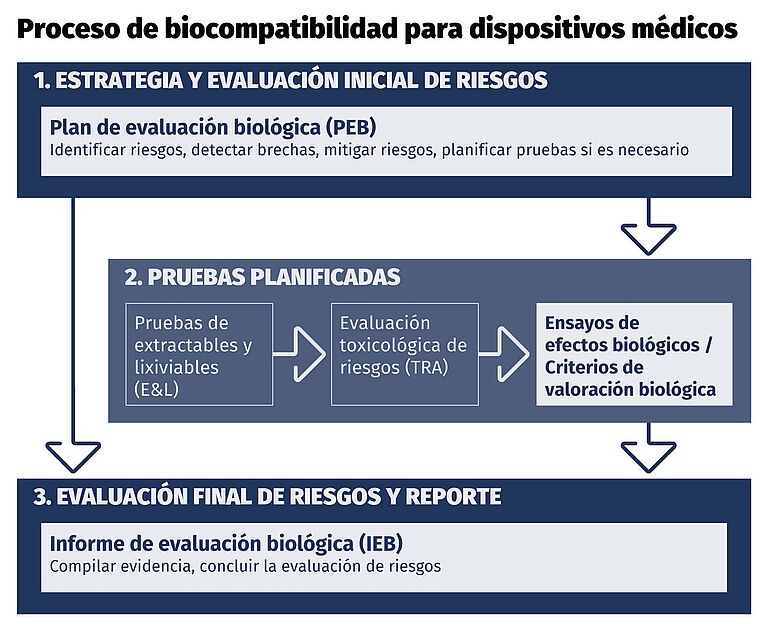
Proceso de biocompatibilidad para dispositivos médicos
La evaluación de la seguridad biológica se realiza mediante un enfoque estructurado y basado en evidencia:
- Un Plan de Evaluación Biológica (BEP) identifica los peligros biológicos, los efectos o endpoints biológicos aplicables, los datos existentes y las brechas de datos
- Si se identifican brechas, se realizan pruebas biológicas basadas en riesgos para abordar posibles daños
- Según los materiales y la exposición, esto puede incluir:
- Estudios de extraíbles y lixiviables (E&L)
- Evaluación toxicológica de riesgos (TRA)
- Todos los datos y la justificación se recopilan en un Informe de Evaluación Biológica (BER), que documenta:
- Efectos o endpoints biológicos evaluados
- Aceptabilidad del riesgo
- Seguridad biológica general y cumplimiento regulatorio